事例紹介
富士フイルムが設計・製造した2つのリポソーム治験薬が臨床試験中です。
トポテカンの例:リポソームによる薬物動態、有効性-安全性のプロファイルの改善

富士フイルムが設計・製造したFF-10850は、DHSMをベースとしたトポテカン内包リポソームの注射剤です。トポテカンは従来、リポソーム脂質二重膜の透過度が高かったのですが、DHSMベースのリポソームを使用することにより、3年以上の冷蔵保存が可能となりました。
FF-10850は現在アメリカで臨床試験中です。
動態改善

有効性向上

- Steel-Dwass検定により統計解析を行った(※ 、P<0.05)
毒性低減


免疫チェックポイント阻害剤とトポテカン併用療法の有効性
生存率


- Log-rank検定により統計解析を行った
(*, P < 0.05; **, P < 0.01; and ***, P < 0.001) - Susumu Shimoyama et al, Mol Cancer Ther 2023
DHSMベースのリポソームトポテカンは、in vivoで高い薬効と安全性を示し、PD-1Abとの高い併用効果を示しました。
(Susumu Shimoyama et al, Mol Cancer Ther 2023)
ゲムシタビンの例:リポソーム製剤による免疫チェックポイント阻害剤(ICI)との併用効果の増強

富士フイルムが設計・製造したFF-10832は、アメリカで臨床試験を開始した唯一のゲムシタビン内包リポソーム製剤です。
冷蔵条件下で3年以上の安定性が確認されています。
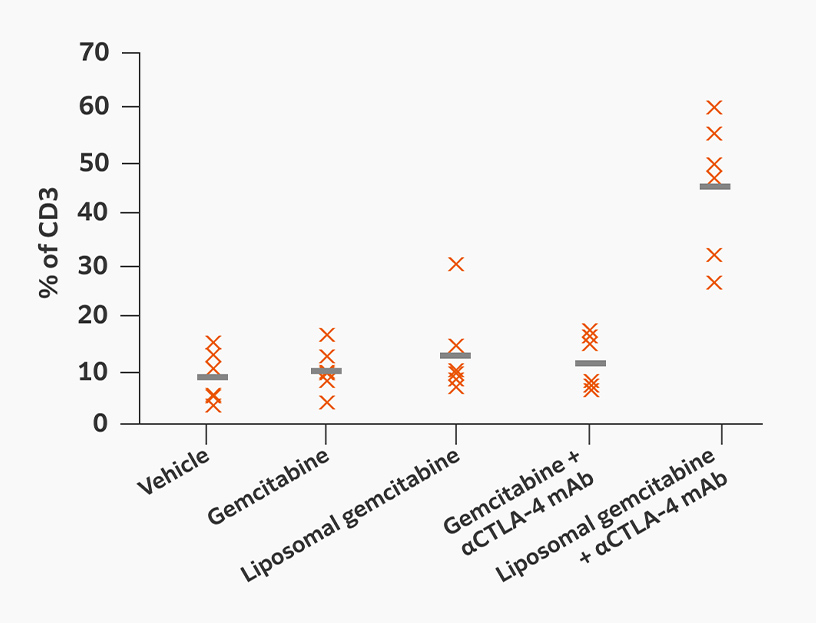
マウス腫瘍モデルでのゲムシタビンとCTLA-4阻害剤併用療法の有効性


腫瘍微小環境

M2 cell

M1 cell

CD8 T cell
- Poster presentation of AACR Annual meeting 2019, in Atlanta from March 29th to April 3rd
ゲムシタビン内包リポソーム製剤は、腫瘍微小環境におけるM2マクロファージの減少とM1マクロファージ、CD8陽性T細胞の増加だけでなく、EPR(Enhanced permeation and retention effect)効果による腫瘍組織への有効成分の高蓄積という二重の効果により、CTLA-4免疫チェック阻害剤(ICI)との併用効果を高めます。
- *1 薬剤の効果を最大限発揮させるための制御技術であり、必要な時間・場所に必要最小限の薬剤を届けることを目指しています。